Imaginez la scène : par une matinée de printemps, un mâle de Mésange charbonnière file infatigablement entre le sol et la cavité d’un arbre. En alternance avec la femelle, il capture insectes et larves pour nourrir sa nichée, et se tient prêt à défendre le nid avec ferveur en cas d’intrusion d’un prédateur. Un vrai modèle de père attentionné. Pourtant, si l’on se fie à l’ADN de ses poussins, il se pourrait bien que tous ne soient pas les siens…

Stratégies reproductrices chez les passereaux
Le cas de la polyandrie
Un couple modèle… ou presque
Tourterelles, hirondelles… on parle bien souvent des oiseaux comme des symboles d’un amour puissant et fidèle. Et c’est ce qu’on a longtemps cru ! David Lack (1968) estimait à 90% la proportion d’espèces d’oiseaux monogames, c’est-à-dire formant un couple fidèle pendant au moins une saison de reproduction [1]. Sur les chiffres, il n’avait pas totalement tort. Mais sur le concept, il manquait une nuance essentielle : malgré le couple social, sur le plan sexuel, on est en réalité loin, très loin, de la monogamie.
C’est vers la fin des années 1980, grâce aux premières études de fingerprinting ADN, que le voile a été levé sur ces amours multiples [2,3,4]. Tout a commencé avec le Moineau domestique. Chez des couples à l’apparence fidèle, les analyses génétiques ont révélé la présence simultanée – au sein d’un même nid – de poussins « légitimes » et d’un poussin ne partageant pas le matériel génétique du père-présumé [2]. Toutes précautions prises, les auteurs ont conclu que l’hypothèse la plus probable était que ce poussin soit issu d’un mâle externe au couple, mais bien pondu par la même mère.
Par la suite, les découvertes de nids avec « intrus » se sont multipliés, chez des groupes d’espèces très variés. Notons par exemple le Bruant des roseaux (jusqu’à 86% de nichées mixtes !) [5], mais aussi le Grand cormoran [6], le Diamant mandarin [7] ou encore l’Étourneau unicolore [8]… pour ne citer qu’eux. À ce stade, le concept de monogamie devient ambigu, et la littérature voit donc apparaître une distinction entre la monogamie sociale (= le fait de former un couple social et prendre soin de la nichée ensemble) et la monogamie génétique/sexuelle. Entendez par là : le fait de se reproduire uniquement avec son partenaire [9,10].

Jeunes mésanges charbonnières quémandant de la nourriture.
Au niveau des chiffres, on estime toujours bien que 80 à 90% des espèces d’oiseaux sont monogames du point de vue social, mais plus des trois-quarts d’entre elles présentent des occurrences de nichées à géniteurs multiples [11,12,13] ! Quand ces cas d’infidélité sont détectés chez une espèce, le comportement n’est pas généralisé chez tous les couples : il se manifeste en moyenne chez 30% d’entre eux, et les oeufs illégitimes sont en quantité moindre par rapport à ceux provenant du “vrai père” [11,12,14].
Dans la famille des infidélités, la polygynie sexuelle (= le fait qu’un mâle insémine plusieurs femelles) est facilement compréhensible d’un point de vue physiologique et mécanique. Mais qu’en est-il de la polyandrie sexuelle ? Comment est-ce possible qu’une femelle ponde des œufs issus de mâles différents au sein d’une même nichée ? Pour le comprendre, il faut plonger dans l’intimité de ces dames…
Système reproducteur de la femelle
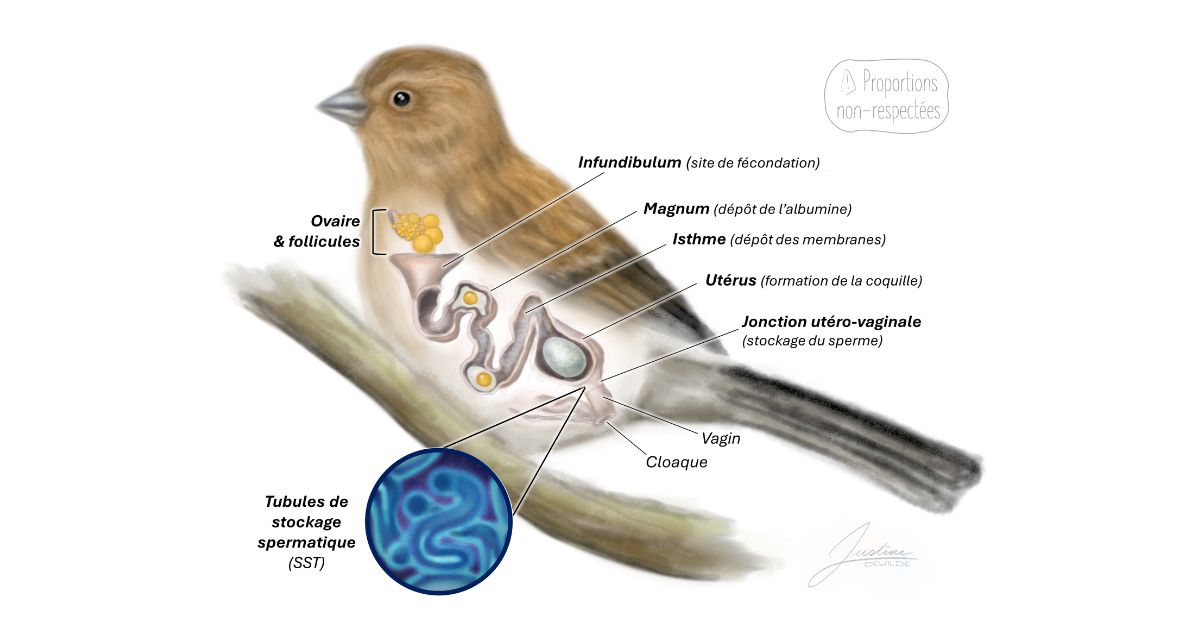
Illustration de l’organe reproducteur d’un passereau femelle (proportions non respectées) - ©Justine Dewilde
Chez les femelles de passereaux, il y a un seul ovaire, composé de plusieurs follicules à des stades de maturité différents [15,16]. Quand madame est suffisamment stimulée, le follicule le plus mature va libérer un ovule dans une sorte d’entonnoir : l’infundibulum. C’est précisément là que la rencontre avec le spermatozoïde doit avoir lieu [15]. Et l’ovule n’y reste pas longtemps, environ 15-20 minutes [16,17,18] ! Une fois fécondé, l’ovule peut entamer sa descente d’un long canal appelé oviducte. En l’espace d’une vingtaine d’heures, il va progressivement se faire entourer d’albumine, puis d’une membrane et d’une coquille, pour enfin se faire déposer via le cloaque [15,16]. Et voilà, vous avez un œuf !
Dans l’heure qui suit la ponte, un nouvel ovule sera disponible pour la fécondation. Mais rappelez-vous : il ne reste dans l’infundibulum que pendant 15 à 20 minutes. Cela voudrait donc dire que dans l’espoir d’avoir un deuxième œuf, le mâle doit être à l’affût pour inséminer la femelle juste après sa ponte ? Heureusement, non ! Les oiseaux disposent d’une adaptation extraordinaire : les tubules de stockage spermatique (Sperm Storage Tubules, SST) [15,16,19]. Ces minuscules replis, situés près de la jonction utéro-vaginale (vers le bas de l’oviducte), sont capables de conserver les spermatozoïdes vivants pendant quelques jours à plusieurs semaines [15,20].
Ainsi, après s’être accouplée avec un mâle, la femelle peut garder son sperme « en réserve » dans ces petites loges, et même stocker celui d’un ou plusieurs autres ! Lors de la période fertile, des signaux hormonaux (notamment via la progestérone) vont induire la libération d’une partie des spermatozoïdes stockés dans les tubules [20]. La course commence alors : il faudra être le premier à remonter tout l’oviducte, et présenter une compatibilité suffisante avec l’ovule pour espérer être l’heureux fécondateur [21] ! À chaque nouveau cycle (5-6 pontes en général chez les passereaux), la course recommence avec son nouveau lot de prétendants. Résultat : selon les proportions de sperme de chaque mâle et leur composition, le vainqueur ne sera pas toujours le même, et une nichée pourra donc réunir des poussins de pères différents !
Une question vous taraude peut-être : la femelle exerce-t-elle un quelconque contrôle sur le sperme qui va être utilisé pour chaque fécondation ?
Elle a fait un bébé toute seule¹
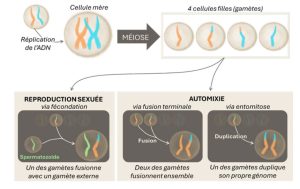
Jean-Jacques Goldman ne croyait pas si bien dire… Chez plusieurs invertébrés, il existe une forme de reproduction asexuée – la parthénogenèse – où la femelle peut donner la vie sans aucune intervention d’un mâle ! De façon étonnante, ce phénomène a aussi été documenté chez des reptiles, amphibiens et poissons… et même certains oiseaux en captivité !
Souvent, les œufs parthénogénétiques des oiseaux n’aboutissent pas à éclosion. Mais en 2021, un cas surprenant a été documenté chez l’un des plus grands oiseaux du monde : le Condor de Californie. Des analyses ADN ont révélé l’absence de contribution paternelle chez deux jeunes, Tous deux étaient des mâles (ce qui est cohérent avec le système homogamétique ZZ des oiseaux) et ont vécu jusqu’à 2 et 8 ans, ce qui est court pour l’espèce. Bien qu’on ne puisse pas certifier que leur conception particulière soit responsable, tous deux présentaient tout de même des comportements atypiques et une certaine fébrilité.
Pour les amateurs de notions très techniques : sur les 21 marqueurs génétiques étudiés, les jeunes étaient homozygotes (= les deux allèles identiques pour chaque gène). Ces résultats suggèrent une automixie, un type de parthénogenèse où la méiose (= double division cellulaire) a bien lieu, mais où des noyaux cellulaires de l’individu fusionnent entre eux, plutôt qu’avec une cellule d’un individu externe (en l’occurrence, le spermatozoïde). Deux mécanismes peuvent l’expliquer : soit (1) la fusion terminale de 2 des 4 cellules (gamètes) issues de méiose, soit (2) une endomitose, c’est-à-dire qu’au sein d’une des 4 cellules, le noyau se duplique et re-fusionne avec lui-même. Dans le premier cas, le génome ne sera que partiellement homozygote, tandis que dans le deuxième, il le sera presque entièrement. Les auteurs, n’ayant étudié qu’une partie du génome, n’ont pas pu discriminer lequel de ces mécanismes a eu lieu.
1. Publication de référence : Ryder, O. A., et. al. (2021). Facultative Parthenogenesis in California Condors. Journal of Heredity, 112(7), 569‑574.
Le pouvoir caché des femelles
Au risque d’en décevoir certains ou certaines, il n’existe aucune preuve formelle que la femelle exerce un réel contrôle sur le sperme qui va être utilisé pour la fécondation, à partir du moment où il est stocké dans les SST. Mais une influence comportementale et physiologique peut tout de même intervenir dans les étapes préliminaires au stockage, permettant d’augmenter les chances de certains mâles par rapport à d’autres.
1) Contrôle comportemental : si elles ne peuvent choisir quel sperme va être utilisé in fine, les femelles peuvent tout de même choisir avec qui elles s’accouplent, à quel moment, et à quelle fréquence !
La théorie de la « priorité au dernier sperme » stipule que sur plusieurs copulations successives suffisamment espacées dans le temps (au moins quelques heures), la plus tardive aura la plus grande probabilité de réussite [10,14]. Plusieurs mécanismes peuvent expliquer ce phénomène [14] :
– La stratification du sperme dans les tubules de stockage (en simplifié : dernier entré, premier sorti) ;
– Le remplacement du sperme précédent via déplacement ou attaque physico-chimique ;
– Les changements de proportion entre les multiples spermes via perte passive.
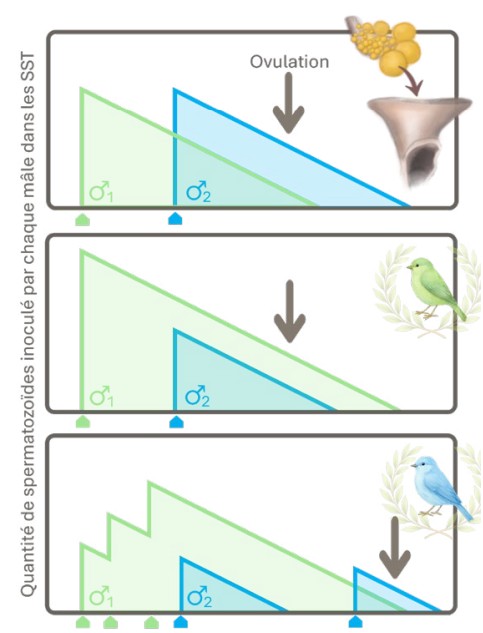
Représentation graphique de la perte passive des spermatozoïdes, et des multiples issues possibles selon le moment et la fréquence des copulations. Inspiré de Birkhead et. al. (1998).
Cette dernière explication est la plus communément évoquée. Concrètement : si les spermatozoïdes survivent dans les SST pendant un temps limité, leur taux initial aura déjà diminué au moment d’une deuxième insémination [10,16,22]. À quantités inséminées égales, le deuxième prend donc le dessus sur le premier (Image 2). Par contre, si le deuxième inocule moins que le premier, sa proportion peut rester inférieure. Sauf si la reproduction se passe vraiment longtemps après la première, quand la quantité initiale aura nettement diminué. Vous suivez ? Ajoutez à cela un effet cumulatif (davantage d’accouplements avec un même mâle = davantage de sperme), et vous comprendrez toutes les possibilités que cela laisse à la femelle (et aux mâles forceurs) pour influencer l’issue de ces accouplements multiples [10,24].
Pour être complet, il faut ajouter que le moment de l’insémination par rapport à la période fertile est aussi décisif. La période optimale se trouve entre deux jours avant la première ponte et le jour-même de celle-ci [22]. À partir de la première ponte, il y a davantage de risques que le sperme ne puisse pas remonter jusqu’aux SST à cause des contractions nécessaires à l’oviposition [23]. Sachant cela, l’hypothèse d’un « choix délibéré » du moment le plus propice à l’accouplement est notamment soutenue par une étude sur le Gobemouche à collier, où on observe que les femelles infidèles choisissent surtout le milieu et la fin de leur période fertile pour s’accoupler avec des amants aux caractères sexuels plus attractifs que leur conjoint [24].
En résumé : en contrôlant la temporalité et le nombre d’accouplements avec chaque mâle, les femelles ont déjà pas mal de cartes en mains. Et c’est sans compter un dernier coup de poker : chez plusieurs espèces, elles sont même capables d’éjecter une partie du sperme qui leur a été inoculé [25,26] ! Dans le système social très hiérarchisé des Coqs dorés, les femelles éjectent notamment le sperme non-désiré des mâles subordonnés [25].

2) Contrôle physiologique ?
Une fois le sperme introduit, les processus qui se déroulent dans l’appareil reproducteur sont difficiles à étudier in vivo. Sur le plan scientifique, il est presque impossible de distinguer clairement une simple compétition spermatique d’un véritable « choix » du sperme [27]. L’idée même d’un contrôle actif est d’ailleurs rarement avancée. Ce que l’on sait, en revanche, c’est que seuls 1 à 2 % des spermatozoïdes parviennent jusqu’à la jonction utéro-vaginale. Cela implique donc forcément une forme de sélection, probablement involontaire. On peut regrouper les processus de sélection en deux grands groupes : la compatibilité (mâle – femelle) et la compétition spermatique (mâle VS mâle).
Sans entrer dans trop de détails biochimiques, la compatibilité est liée à des aspects génétiques et physiologiques. Les interactions entre certaines protéines et des récepteurs moléculaires peuvent induire une réponse immunitaire de la part de la femelle, visant à neutraliser les corps étrangers [16,18,28]. Il est parfois aussi fait mention d’incompatibilité génétique [29]. On fait donc référence ici à une sélection très ciblée.
Dans le cas de la compétition, il n’est pas question d’attaque ciblée. Simplement, les spermatozoïdes devront faire de leur mieux pour survivre et se déplacer, malgré les bâtons mis dans leurs roues. Que cela soit la composition des fluides génitaux (pH, viscosité, environnement chimique…) ou la longueur variable de l’oviducte, l’évolution a conféré aux femelles plusieurs barrières naturelles, au travers desquelles seuls les plus compétitifs peuvent se frayer un chemin [14,16,30,31]. Une étude in vitro suggère même que chez l’Hirondelle rustique, les barrières des femelles « de qualité » seraient plus restrictives, afin d’assurer l’utilisation d’un sperme vraiment performant [32].
Mais comment se caractérise cette performance ? Est-ce que la probabilité de franchir les barrières est déterminée par le nombre de spermatozoïdes dans le liquide séminal [33,34] ? Leur taille [10,14,35] ? Leur mobilité [36,37] ? Leur longévité [38] ? La réponse est d’autant moins évidente que ces paramètres sont souvent soumis à des compromis entre eux (ex : dans un testicule d’une taille donnée, des spermatozoïdes plus grands ou longs pourront être moins nombreux) [39,40]. Les études plus récentes semblent converger vers le constat qu’il n’y a pas de réponse universelle : on ne peut évaluer la qualité d’un sperme sur des caractéristiques fixes, mais plutôt sur sa capacité à s’en sortir dans les conditions imposées par une femelle donnée, en compétition avec d’autres mâles donnés [41,42].
Du point de vue physiologique, on ne peut donc pas vraiment dire que la femelle ait le contrôle, mais plutôt qu’une sélection cryptique s’opère pour maximiser les chances de son « partenaire sexuel » idéal.
Anatomie du consentement²
Chez la grande majorité des oiseaux, ce sont les femelles qui ont le dernier mot sur l’accouplement. La copulation n’implique pas de pénétration : mâle et femelle pressent leurs cloaques l’un contre l’autre, ce que l’on appelle le « baiser cloacal ». Pour que la fécondation soit possible, la femelle doit donc coopérer et adopter la posture adéquate. Cette configuration limite considérablement les possibilités de contrainte par le mâle.
Il existe toutefois quelques exceptions remarquables. Environ 3% des espèces – notamment nombreux anatidés, dont le Canard colvert – possèdent un organe copulateur érectile. Ce pénis, parfois spiralé et de longueur surprenante, a évolué dans un contexte de forte compétition sexuelle. Dans ces groupes, les tentatives d’accouplement coercitif sont plus fréquentes, et les femelles ont développé des structures internes complexes qui leur permettent, en retour, de conserver un contrôle partiel sur la fécondation.
²Brennan, P. L. R. (2022). Bird genitalia. Current Biology, 32(20), R1061‑R1062.
Les mâles contre-attaquent
Face aux leviers dont disposent les femelles, les mâles n’ont pas dit leur dernier mot. Eux aussi ont développé quelques stratégies pour maximiser leurs chances de fécondation. À défaut de pouvoir contrôler les caractéristiques physico-chimiques de leurs semences, c’est principalement sur le plan comportemental que les mâles vont tenter de sécuriser l’union.

Le mate guarding est un classique, notamment documenté chez la Pie bavarde : monsieur reste collé à la femelle pendant toute la durée de sa période fertile [43]. C’est énergivore, mais au moins, il s’assure de limiter au maximum les risques qu’un rival s’accouple avec sa belle. Ceci étant dit, ce comportement l’empêche d’aller lui-même voir ailleurs, alors qu’il aurait pu maximiser ses chances de descendance en fécondant une autre femelle [44,45]. Dias et. al (2009) avancent que les mâles de moins bonne qualité auraient une plus grande tendance à faire appel à cette technique de sécurisation [44].
Chez d’autres espèces, comme l’Accenteur mouchet, cela va encore plus loin [26] : lorsque plusieurs mâles tournent autour d’une femelle, l’insistance devient trop forte et le mate guarding ne suffit plus. Le mâle souhaitant s’accoupler (qu’il soit le partenaire ou l’amant) va alors picorer le cloaque de la femelle, parfois jusqu’à deux minutes ! Cette stimulation génèrera des contractions de plus en plus fortes, jusqu’à provoquer une évacuation du contenu cloacal. Dans certains cas, ce sont des fèces qui en sortent. Mais si la femelle s’est fait inséminer peu de temps avant, c’est une partie du sperme précédent qui sera éjectée ! On a là une stratégie laborieuse, qui ne réussit pas toujours, mais sacrément efficace quand elle fonctionne.
Enfin, à l’instar du comportement de la femelle, les mâles peuvent maximiser leurs chances par des copulations répétées (jusqu’à une vingtaine de tentatives par heure chez l’Hirondelle bicolore [46]) qui visent à saturer les SST de leur propre sperme. Cette stratégie, moins documentée, serait adoptée par les espèces où le mate guarding est rendu impossible à cause d’expéditions trop lointaines ou trop fréquentes, notamment pour la recherche de nourriture [47]. Elle serait, néanmoins, moins efficace pour garantir la paternité [47].
Au final, qui en ressort gagnant ?

Nid de Pie-grièche échorcheurs Nid de Pie-grièche échorcheurs - ©Justine Dewilde
Les escapades extra-conjugales ne sont pas sans coût. La femelle qui s’engage dans ce comportement risque d’engendrer une baisse des soins paternels : même si ce n’est pas toujours le cas [8,48], un mâle trompé pourrait moins s’investir dans le soin de sa couvée s’il soupçonne que certains œufs ne sont pas les siens [49,50]. Cela peut aussi, dans une certaine mesure, augmenter le risque de transmission de pathogènes via le cloaque [51,52].
Et pourtant, sur le plan évolutif, les bénéfices peuvent compenser ces coûts : une diversité génétique au sein de la nichée augmente la probabilité qu’elle présente des « bons gènes », et augmente la résilience face aux maladies, aux parasites ou aux variations de milieu [53]. Les femelles chercheraient ainsi à obtenir le « meilleur des deux mondes » : la sécurité matérielle d’un partenaire fidèle, et les gènes avantageux d’un autre. Quant aux mâles, même si cela implique d’allouer une partie de leur énergie à des gènes qui ne sont pas les leurs, maintenir un couple social – même imparfait – reste leur meilleure garantie d’engendrer une descendance.
Cette question de l’intérêt évolutif – pour chacun des sexes et pour l’espèce – du maintien du couple social malgré des relations infidèles évidentes, reste largement débattue dans la littérature (voir [11, 54 et 55] pour une introduction au sujet via des points de vue opposés). Et pour cause, ces comportements n’ont rien d’anecdotique : ils façonnent l’évolution des espèces, influencent la diversité génétique, et dessinent, à leur petite échelle, les trajectoires futures des populations.
Alors, la prochaine fois que vous observerez ce couple de mésanges nourrissant leurs jeunes, souvenez-vous : ce n’est peut-être pas de la fidélité absolue… mais c’est en tout cas une histoire d’entraide, de coopération, où chaque parent fait de son mieux pour transmettre à ce monde… une partie de ses gènes.
Pour aller loin
Bibliographie
[1] Lack, D. (1968). Ecological adaptations for breeding in birds. Methuen & Co. Ltd.
[2] Burke, T., & Bruford, M. W. (1987). DNA fingerprinting in birds. Nature, 327(6118), 149‑152.
[3] Wetton, J. H., Carter, R. E., Parkin, D. T., & Walters, D. (1987). Demographic study of a wild house sparrow population by DNA fingerprinting. Nature, 327(6118), 147‑149.
[4] Gibbs, H. L., Weatherhead, P. J., Boag, P. T., White, B. N., Tabak, L. M., & Hoysak, D. J. (1990). Realized reproductive success of polygynous red-winged blackbirds revealed by DNA markers. Science, 250(4986), 1394‑1397.
[5] Dixon, A., Ross, D., O’Malley, S. L. C., & Burke, T. (1994). Paternal investment inversely related to degree of extra-pair paternity in the reed bunting. Nature, 371(6499), 698‑700.
[6] Minias, P., Wojczulanis-Jakubas, K., Rutkowski, R., Kaczmarek, K., & Janiszewski, T. (2016). Spatial patterns of extra-pair paternity in a waterbird colony :Separating the effects of nesting density and nest site location. Behavioral Ecology and Sociobiology, 70(3), 369‑376.
[7] Birkhead, T. R., Burke, T., Zann, R., Hunter, F. M., & Krupa, A. P. (1990). Extra-pair paternity and intraspecific brood parasitism in wild zebra finches Taeniopygia guttata, revealed by DNA fingerprinting. Behavioral Ecology and Sociobiology, 27(5), 315‑324.
[8] García-Vigón, E., Veiga, J. P., & Cordero, P. J. (2009). Male feeding rate and extrapair paternity in the facultatively polygynous spotless starling. Animal Behaviour, 78(6), 1335‑1341.
[9] Westneat, D. F., Sherman, P. W., & Morton, M. L. (1990). The ecology and evolution of extra‐pair copulations in birds. In Current ornithology (Vol. 7, p. 331‑369). Plenum Press.
[10] Birkhead, T. (1998). Sperm competition in birds. Reviews of Reproduction, 3(2), 123‑129.
[11] Brouwer, L., & Griffith, S. C. (2019). Extra‐pair paternity in birds. Molecular Ecology, 28(22), 4864‑4882.
[12] Griffith, S. C., Owens, I. P. F., & Thuman, K. A. (2002). Extra pair paternity in birds :A review of interspecific variation and adaptive function. Molecular Ecology, 11(11), 2195‑2212.
[13] Kempenaers, B. (2022). Mating systems in birds. Current Biology, 32(20), R1115‑R1121.
[14] Birkhead, T. R., & Montgomerie, R. (2020). Three decades of sperm competition in birds. Philosophical Transactions of the Royal Society B:Biological Sciences, 375(1813), 20200208.
[15] Sasanami, T., Matsuzaki, M., Mizushima, S., & Hiyama, G. (2013). Sperm storage in the female reproductive tract in birds. The Journal of Reproduction and Development, 59(4), 334‑338.
[16] Assersohn, K., Brekke, P., & Hemmings, N. (2021). Physiological factors influencing female fertility in birds. Royal Society Open Science, 8(7), 202274.
[17] Warren, D. C., & Scott, H. M. (1935). The time factor in egg formation. Poultry Science, 14(4), 195‑207.
[18] Khillare, G. S., Sastry, K. V. H., Agrawal, R., Prakash, A., Mohan, J., & Singh, R. P. (2018). Molecular and biochemical events in sperm storage tubules of oviduct in birds. World’s Poultry Science Journal, 74(1), 35‑44.
[19] Bakst, M. R., & Vinyard, B. T. (2002). Oviducal sperm storage in turkeys :Spatial distribution of sperm within the uterovaginal junction sperm‐storage tubules. Journal of Experimental Zoology, 292(2), 206‑209.
[20] Ito, T., Yoshizaki, N., Tokumoto, T., Ono, H., Yoshimura, T., Tsukada, A., Kansaku, N., & Sasanami, T. (2011). Progesterone is a sperm-releasing factor from the sperm-storage tubules in birds. Endocrinology, 152(10), 3952‑3962.
[21] Birkhead, T. R., & Pizzari, T. (2002). Postcopulatory sexual selection. Nature Reviews Genetics, 3(4), 262‑273.
[22] Colegrave, N., Birkhead, T. R., & Lessells, C. M. (1995). Sperm precedence in zebra finches does not require special mechanisms of sperm competition. Proceedings of the Royal Society of London. Series B:Biological Sciences, 259(1355), 223‑228.
[23] Birkhead, T. R. (1996). The insemination window provides a distorted view of sperm competition in birds. Proceedings of the Royal Society of London. Series B:Biological Sciences, 263(1374), 1187‑1192.
[24] Michl, G., Török, J., Griffith, S. C., & Sheldon, B. C. (2002). Experimental analysis of sperm competition mechanisms in a wild bird population. Proceedings of the National Academy of Sciences, 99(8), 5466‑5470.
[25] Pizzari, T., & Birkhead, T. R. (2000). Female feral fowl eject sperm of subdominant males. Nature, 405(6788), 787‑789.
[26] Davies, N. B. (1983). Polyandry, cloaca-pecking and sperm competition in dunnocks. Nature, 302(5906), 334‑336.
[27] Birkhead, T. R. (1998). Cryptic female choice :Criteria for establishing female sperm choice. Evolution, 52(4), 1212‑1218.
[28] Zeh, J. A., & Zeh, D. W. (1997). The evolution of polyandry II :Post–copulatory defenses against genetic incompatibility. Proceedings of the Royal Society of London. Series B:Biological Sciences, 264(1378), 69‑75.
[29] Løvlie, H., Gillingham, M. A. F., Worley, K., Pizzari, T., & Richardson, D. S. (2013). Cryptic female choice favours sperm from major histocompatibility complex-dissimilar males. Proceedings of the Royal Society B:Biological Sciences, 280(1769), 20131296.
[30] Birkhead, T. R., Møller, A. P., & Sutherland, W. J. (1993). Why do females make it so difficult for males to fertilize their eggs? Journal of Theoretical Biology, 161(1), 51‑60.
[31] Huang, A., Isobe, N., & Yoshimura, Y. (2017). Changes in localization and density of CD63-positive exosome-like substances in the hen oviduct with artificial insemination and their effect on sperm viability. Theriogenology, 101, 135‑143.
[32] Møller, A. P., Mousseau, T. A., & Rudolfsen, G. (2008). Females affect sperm swimming performance :A field experiment with barn swallows Hirundo rustica. Behavioral Ecology, 19(6), 1343‑1350.
[33] Hemmings, N., & Birkhead, T. R. (2015). Polyspermy in birds :Sperm numbers and embryo survival. Proceedings of the Royal Society B:Biological Sciences, 282(1818), 20151682.
[34] Rowe, M., Van Oort, A., Brouwer, L., Lifjeld, J. T., Webster, M. S., Welklin, J. F., & Baldassarre, D. T. (2022). Sperm numbers as a paternity guard in a wild bird. Cells, 11(2), 231.
[35] Bennison, C., Hemmings, N., Slate, J., & Birkhead, T. (2015). Long sperm fertilize more eggs in a bird. Proceedings of the Royal Society B:Biological Sciences, 282(1799), 20141897.
[36] Birkhead, T. R., Martinez, J. G., Burke, T., & Froman, D. P. (1999). Sperm mobility determines the outcome of sperm competition in the domestic fowl. Proceedings of the Royal Society of London. Series B:Biological Sciences, 266(1430), 1759‑1764.
[37] Kleven, O., Fossøy, F., Laskemoen, T., Robertson, R. J., Rudolfsen, G., & Lifjeld, J. T. (2009). Comparative evidence for the evolution of sperm swimming speed by sperm competition and female sperm storage duration in passerine birds. Evolution, 63(9), 2466‑2473.
[38] Ball, M. A., & Parker, G. A. (1996). Sperm competition games :External fertilization and “adapative” infertility. Journal of Theoretical Biology, 180(2), 141‑150.
[39] Lüpold, S., Manier, M. K., Puniamoorthy, N., Schoff, C., Starmer, W. T., Luepold, S. H. B., Belote, J. M., & Pitnick, S. (2016). How sexual selection can drive the evolution of costly sperm ornamentation. Nature, 533(7604), 535‑538.
[40] Immler, S., Pitnick, S., Parker, G. A., Durrant, K. L., Lüpold, S., Calhim, S., & Birkhead, T. R. (2011). Resolving variation in the reproductive tradeoff between sperm size and number. Proceedings of the National Academy of Sciences, 108(13), 5325‑5330.
[41] Cramer, E. R. A., Yilma, Z. B., & Lifjeld, J. T. (2023). Selection on sperm size in response to promiscuity and variation in female sperm storage organs. Journal of Evolutionary Biology, 36(1), 131‑143.
[42] Lüpold, S., & Pitnick, S. (2018). Sperm form and function :What do we know about the role of sexual selection? Reproduction, 155(5), R229‑R243.
[43] Birkhead, T. R. (1979). Mate guarding in the magpie Pica pica. Animal Behaviour, 27, 866‑874.
[44] Dias, R. I., Salles, P., & Macedo, R. H. (2009). Mate guarding and searching for extra-pair copulations :Decision-making when interests diverge. Ecological Informatics, 4(5‑6), 405‑412.
[45] Hasselquist, D., & Bensch, S. (1991). Trade-off between mate guarding and mate attraction in the polygynous great reed warbler. Behavioral Ecology and Sociobiology, 28(3).
[46] Crowe, S. A., Kleven, O., Delmore, K. E., Laskemoen, T., Nocera, J. J., Lifjeld, J. T., & Robertson, R. J. (2009). Paternity assurance through frequent copulations in a wild passerine with intense sperm competition. Animal Behaviour, 77(1), 183‑187.
[47] Harts, A. M. F., Booksmythe, I., & Jennions, M. D. (2016). Mate guarding and frequent copulation in birds :A meta-analysis of their relationship to paternity and male phenotype. Evolution, 70(12), 2789‑2808.
[48] Bouwman, K. M., Lessells, C. M., & Komdeur, J. (2005). Male reed buntings do not adjust parental effort in relation to extrapair paternity. Behavioral Ecology, 16(3), 499‑506.
[49] Møller, A. P., & Birkhead, T. R. (1993). Certainty of paternity covaries with paternal care in birds. Behavioral Ecology and Sociobiology, 33(4), 261‑268.
[50] Lifjeld, J. T., Slagsvold, T., & Ellegren, H. (1998). Experimentally reduced paternity affects paternal effort and reproductive success in pied flycatchers. Animal Behaviour, 55(2), 319‑329.
[51] Poiani, A. (2010). Do cloacal pathogenic microbes behave as sexually transmitted parasites in birds? The Open Ornithology Journal, 3(1), 72‑85.
[52] Poiani, A., & Wilks, C. (2000). Sexually transmitted diseases :A possible cost of promiscuity in birds? The Auk, 117(4), 1061‑1065.
[53] Foerster, K., Delhey, K., Johnsen, A., Lifjeld, J. T., & Kempenaers, B. (2003). Females increase offspring heterozygosity and fitness through extra-pair matings. Nature, 425(6959), 714‑717.
[54] D’Amelio, P. B., Covas, R., Ferreira, A. C., Fortuna, R., Silva, L. R., Theron, F., Rybak, F., & Doutrelant, C. (2024). Benefits of pair-bond duration on reproduction in a lifelong monogamous cooperative passerine. The American Naturalist, 203(5), 576‑589.
[55] Kvarnemo, C. (2018). Why do some animals mate with one partner rather than many? A review of causes and consequences of monogamy. Biological Reviews, 93(4), 1795‑1812.


